Resumo
A reabilitação prematura na UTI busca promover melhora da função respiratória, do posicionamento correto e de todas as implicações deletérias causadas pelo imobilismo. O ortostatismo passivo realizado por meio de uma prancha ortostática promove a mobilização do indivíduo beneficiando com a melhora do quadro funcional. Objetivos: Mostrar os benefícios do uso da prancha ortostática bem como avaliar os efeitos hemodinâmicos no paciente oncológico. Procedimentos metodológicos: Estudo de caso em um paciente oncológico que foi submetido ao ortostatismo passivo com auxílio de prancha ortostática de forma progressiva partindo de 0º até atingir aproximadamente 90° permanecendo por cinco minutos e retornando gradativamente para posição inicial. Resultados:Durante a execução do procedimento os sinais vitais apresentaram-se satisfatórios e ocorreu leve aumento da SpO2. O paciente demonstrou mais independência no posicionamento. Conclusão: A prancha ortostática pode ser considerada uma ferramenta para promover a mobilização de pacientes na UTI, melhorando a funcionalidade dos enfermos.
Unitermos: Terapia intensiva. Fisioterapia. Reabilitação. Mobilização precoce.
Presenteado em II Bioergonomics – International Congress of Biomechanics and Ergonomics do 4 ao 7 de junho em Manaus, Amazonas, Brasil.
Autor: Daniel Xavier
No Brasil é pouco empregado o uso do ortostatismo com o auxílio da prancha ortostática, e, além disso, há poucos estudos científicos baseado neste equipamento. Dentre outras práticas recomendadas ao paciente crítico, a prancha ortostática, promove os benefícios do ortostatismo assistido, que incluemdeslocamento do paciente, ganho de força em membros inferiores, prevenção de atrofia muscular, facilitação no transcorrer do desmame ventilatório, melhora da oxigenação e da ventilação alveolar (Luque et al., 2010).
Na unidade de terapia intensiva (UTI) a reabilitação precoce consiste em técnicas com a finalidade de melhorar a função respiratória, mobilização passiva e ativa, posicionamento adequado do paciente no leito, implantação e supervisão de ventilação não invasiva (VNI) e possíveis ajustes, auxílio da intubação, supervisão de desmame do ventilador mecânico, aspiração e extubação (Norrenberg, 2006).
O fisioterapeuta intensivista é o profissional que se dedica ao atendimento do paciente crítico, efetuando diagnósticos e terapias cinesio-funcionais. Sua importância é reconhecida na Política de Atenção ao Paciente Crítico a qual prevê sua obrigatoriedade em regime exclusivo nas Unidades de Terapia Intensivo (UTIs) em turno manhã, tarde e noite. É função de o profissional fisioterapeuta elaborar o prontuário fisioterapêutico com os diagnósticos, tratamentos funcionais e finalização de alta. Como agente promotor da fisioterapia, deve ser o coordenador dos procedimentos fisioterápicos, orientando os componentes das Unidades, sobretudo técnicos, e sendo o realizador principal dessa atividade (Ferrari, 2009).
O corpo humano tem que se manter constantemente em movimento. Basta sete dias de imobilismo para diminuir em aproximadamente 30% da força muscular, e diante disto, ocorrerá a cada semana seguinte uma perda gradativa de 20% da força muscular que restou. Quanto maior o tempo de internação em uma UTI sob o uso de prótese ventilatória por pressão positiva, maior é a decadência funcional, morbimortalidade e aumento dos gastos hospitalares. A fraqueza está associada além do próprio uso da ventilação mecânica, ao excesso de sedativos, bloqueadores neuromusculares, corticosteroides. Afeta tanto a musculatura esquelética quanto a respiratória, e, consequentemente, acarretará em um desmame difícil, dificultando assim o processo de extubação (Sibinelli et al., 2012).
O paciente admitido na UTI deve ser submetido aos exercícios fisioterápicos prematuramente seja ativo seja passivo. O exercício passivo proporciona prevenção ou minimiza a atrofia muscular, além disso, ambular de forma prematura, o uso de faixas com resistência, eletroestimulação neuromuscular, cicloergômetro e o ortostatismo passivo ou ativo também trazem esses benefícios, entre tantos outros (Luque et al., 2013). Dentre as práticas recomendadas ao doente crítico está a utilização da prancha ortostática (PO) que induz os benefícios da postura vertical (Gosselink et al., 2009). Seu uso passivo pode promover benefícios hemodinâmicos e cardiorrespiratórios, como: o aumento da ventilação, melhora da relação ventilação-perfusão e melhora da função cardiorrespiratória. Através desse método, pode obter melhoras do nível de consciência em virtude do estímulo sensorial, neutralizar a postura flexora frequentemente adotada, e ainda, em virtude da descarga de peso bipodal, promover a prevenção de osteoporose por desuso (Chang et al., 2004).
Este processo condiciona a estimulação do sistema motor, melhora da função cardiopulmonar, circulatório e o seu uso é uma readaptação do paciente na posição perpendicular, além da redução da pressão no tecido cutâneo, contraturas e orientação vestibular. Portanto, há a necessidade de monitorização dos sinais vitais durante este procedimento (Sibinelli et al., 2012).
Alguns estudos referentes ao ortostatismo, que pode passivo quanto ativo, são considerados um recurso terapêutico com intuito de diminuir os efeitos deletérios ocasionados pela imobilização prolongada e citam efeitos pertinentes na prevenção da perda de massa óssea; equilíbrio do sistema hemodinâmico e aumento da resposta hemodinâmica na posição bípede; prevenção de contratura nas articulações; aumento da função urinária e intestinal, diminuição da formação de cálculos e promoção de alívio de pressões que ocorrem na posição sentada, reduzindo a incidência de úlceras por pressão e favorecendo a estimulação motora, melhora da troca gasosa, do estado de alerta, estimulação vestibular e facilitação da resposta postural antigravitacional, a prancha ortostática para assistência do ortostatismo é utilizada com intuito de readaptar os pacientes à posição vertical (Faghri et al., 2001; Jerre et al., 2007).
O ortostatismo através da prancha ortostática é feita com a variação progressiva das angulações, onde a inclinação vai depender do objetivo da terapia e das respostas cardiovasculares associadas à atividade autonômica. Após posicionar o paciente na prancha em decúbito dorsal, e fixar as faixas de proteção, deve ser iniciada a inclinação partindo do ponto de (0° de inclinação) com progressivas evoluções da angulação. Preconiza-se para pacientes ambulatoriais inclinações máximas de 10 a 45 minutos. Não existe descrição na literatura sobre as respostas obtidas em pacientes na UTI. No entanto, alguns estudos iniciais demonstram respostas semelhantes às ocorridas na postura ortostática ativa (Sarmento, 2010).
Conforme o III consenso Brasileiro de ventilação mecânica (2007), o ortostatismo é considerado um recurso terapêutico utilizado para a estimulação motora, melhora da troca gasosa e do estado de alerta (Souza et al., 2010). Seus benefícios incluem melhora no controle autonômico do sistema cardiovascular, facilitação da ventilação e troca gasosa, estimulação vestibular, facilitação da resposta postural antigravitacional, úlceras por pressão, osteoporose e pneumonia associada à ventilação mecânica (PAV) (Winker, 2005; Jerre et al., 2007). Ainda sobre os efeitos benéficos ocasionados pelo uso da PO incluem deslocamento do paciente, ganho de força em membros inferiores, melhora do nível de consciência no coma, prevenção de atrofia muscular, facilitação no transcorrer do desmame ventilatório, melhora da oxigenação e da ventilação alveolar (Chang et al., 2004).
A posição ortostática passiva ou ativa é recomendação D do III Consenso Brasileiro de Ventilação Mecânica e é recomendada para àqueles que apresentam cronicidade e que estejam estáveis. Na postura passiva é empregada a prancha ortostática para o auxílio do enfermo que por algum motivo não é capaz de manter-se verticalmente e com isto reduz os efeitos causados pelo imobilismo. O estímulo sensorial é um desses benefícios que a posição vertical proporciona e a inibição da flexão de tronco que normalmente é adquirida. E é recomendação D desse mesmo Consenso que o exercício passivo em doentes internados em UTI sob VMI, favorece na prevenção dos efeitos adversos trazido pela inatividade do repouso prolongado ocasionando melhora da função circulatória e de manutenção muscular. Lembrando que, os idosos têm maior chance de desenvolver os efeitos negativos relacionados pelo imobilismo (Jerre et al., 2007).
Procedimentos metodológicos
Este estudo foi baseado em artigos científicos e com o uso de uma prancha ortostática ISP® em um paciente em internação dentro da UTI da Fundação Centro de Controle de Oncologia do Amazonas (FCECON).
Paciente E.O.S., sexo: M, pardo, 16 anos, com diagnóstico: neoplasia de mediastino + massa pulmonar, IRpA, síndrome da veia cava superior. No primeiro dia de realização da prancha ortostática, o paciente encontrava-se com 54 dias de internação na UTI, sob ventilação mecânica no modo: PSV, PS: 14 cmH2O, PEEP: 5 cmH2O, FiO2: 30%, obtendo aproximadamente um Vt: ± 0,581L/Min.
O procedimento foi executado após a verificação dos sinais vitais que deveria estar sem anormalidades ou próximo dos valores ideais seguido de higiene brônquica por meio do Shaker (3 X 10 repetições) e em seguida realizado aspiração das vias aéreas. Logo, o enfermo foi colocado sob a prancha e progredindo com uma angulação gradativa para postura vertical com elevação de 15 em 15 graus e intervalos de um minuto entre elas. Quando alcançou 90 graus o mesmo permaneceu por 5 minutos, retornando gradativamente a postura inicial.
A verificação dos sinais vitais foi analisada antes, durante e após o procedimento. Importante ressaltar que, o paciente foi orientado quanto ao processo com o intuito de promover tranquilidade na execução da técnica.
Resultados
Durante o ortostatismo passivo o paciente apresentou os sinais vitais com valores satisfatórios com uma variação pouco significante, como demonstrados na Tabela 1 e Gráfico 1.
Tabela 1. Sinais vitais do primeiro dia de ortostatismo passivo
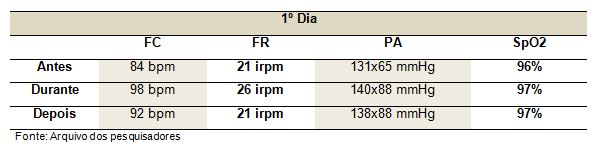
Gráfico 1. Sinais vitais do primeiro dia de ortostatismo passivo
Fonte: Arquivo dos pesquisadores
Após dois dias foi refeito o procedimento e o paciente encontrava-se com 56 dias de internação na UTI, respirando em ar ambiente e verificou-se as variáveis de sinais vitais, de forma que seus valores mais uma vez não apresentaram-se com grande significância (Tabela 2 e Gráfico 2).
Tabela 2. Sinais vitais do segundo dia de ortostatismo passivo
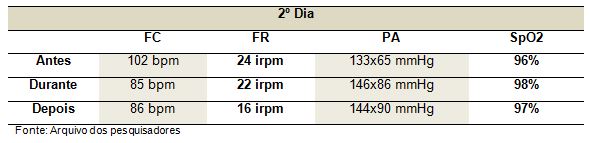
Gráfico 2. Sinais vitais do segundo dia de ortostatismo passivo
Fonte: Arquivo dos pesquisadores
Discussão
Podemos observar nos gráficos que a função hemodinâmica sofreu alteração não muito relevante durante o movimento passivo. Foram avaliadas a frequência cardíaca, a frequência respiratória e a pressão arterial, deixando claro que o indivíduo não sofreu riscos significantes. Já a SpO2, durante a fase de ortostatismo apresentou um leve aumento nos valores, demonstrando que ocorre uma melhora das trocas gasosas durante o ortostatismo passivo. Além disso, o paciente passou a realizar seus posicionamentos de forma mais ativa, evidenciando a melhora de seu quadro funcional.
Este fato é confirmado por Chang, et al., que relatam que os benefícios do uso da prancha ortostática são: deslocamento do paciente, ganho de força dos membros inferiores, melhora do nível de consciência no coma, prevenção de atrofia muscular, facilitar o desmame ventilatório, prevenir úlceras de pressão, melhorar a oxigenação e ventilação alveolar (Chang et al, 2004).
Conclusão
O uso da prancha ortostática no paciente acamado é um fator coadjuvante da fisioterapia, sob o aspecto custo-benefício justifica a inclusão dessa prática no protocolo de fisioterapia enquanto medida terapêutica eficaz e segura. Portanto, para maiores elucidações quanto à eficácia do método, faz-se necessário realizar mais estudos científicos randomizados.
Para trabalho na ´´integra: http://www.efdeportes.com/efd208/ortostatismo-passivo-no-paciente-oncologico.htm
Para trabalho na ´´integra: http://www.efdeportes.com/efd208/ortostatismo-passivo-no-paciente-oncologico.htm
Referências
- Chang, At; Boots, R; Hodges PW; Paratz, J. (2004). Standing with assistance of a tilt table in intensive care: a survey of Australian physiotherapy practice. Australian Journal of Physics. v. 50: p. 51-54.
- Faghri, P.D. et al. (2001). Circulatory hypokinesis and functional electric stimulation during standing in persons with spinal cord injury. Archives of Physical Medicine and Rehabilitation. v. 82(11):1587-1595.
- Gosselink, R; Bott, J; Johnson, M; Dean, E; Nava, S; Norrenberg, M; et al. (2009). Physiotherapy for adult patients with critical illness: recommendations of the European Respiratory Society and European Society of Intensive Care Medicine Task Force on Physiotherapy for Critically Ill Patients. Intensive Care Med. 34:1188-99.
- Jerre, G., et al. (2007). III Consenso Brasileiro de ventilação Mecânica – Fisioterapia no paciente sob ventilação mecânica. Jornal Brasileiro Pneumologia. v. 3(19): p. 399-407.
- Luque, A; Lanza, F. C; Martins, C. G. G.; Gazzotti, M. R.; Silva, M. S. S. (2010). Prancha ortostática nas Unidades de Terapia Intensiva da cidade de São Paulo. O mundo da saúde, São Paulo: v. 34(2): p. 225-229.
- Norrenberg, N; Vincent, Jl. (2000). A profile of European intensive care unit physiotherapists. Intensive Care Med. 26:988-94.
- Sarmento, G. J. V. (2010). Fisioterapia Respiratória no Paciente Crítico – Rotinas Clínicas. Ed.: 3, Barueri, SP: Manole, p. 675.
- Sibinelli, Melissa; Maioral, Daniele Cristina; Falcão, Antônio Luis Eiras; Kosour, Carolina; Dragosavac, Desanka; Lima, Núbia Maria Freire Vieira. (2012). Efeito imediato do ortostatismo em pacientes internados na unidade de terapia intensiva de adultos. Rev Bras Ter Intensiva. 24(1):64-70.





